Результаты и обсуждение
В ходе выполнения курсовой работы на тему «Получение рекомбинантного сосудистого эндотелиального фактора роста» нами был осуществлён химико-ферментативный синтез из перекрывающихся олигонуклеотидов гена человеческого VEGF165. Ген hVEGF165 был оптимизирован по встречаемости кодонов для экспрессии в E. coli. Он был клонирован в экспрессионный вектор pET-23d(+) и получен штамм продуцент E. coli ER2566/ pER-VEGF165. Однако, продукция целевого белка hVEGF165 в клетках E. coli ER2566 была незначительной.
В статье (Hyo Jin Ihm, et al., 2008) была предложена «стоп старт» конструкция для бактериальной системы экспрессии косного морфогенного белка. Авторы отмечали высокий уровень экспрессии BMP-2 за счёт сопряжённой транскрипции мРНК BMP-2 с тиоредоксином. На подобии описанной в литературе конструкции было решено клонировать ген hVEGF165 под стоп кодон тиоредоксина. Кодирующая последовательность тиоредокцина была взята из вектора pET32b+. В кодирующую последовательность тиоредоксина была встроена по сайтам EcoR I и Hind III вставка TRX_STOP. Вставка содержала стоп кодон ТАА, старт кодон ATG и следующий за ним сайт рестрикции Sap I.

Рис. 9. Схема вставки TRX_STOP

Рис. 10. Схема клонирования вставки Trx STOP в вектор pET32b+
Полученную последовательность тиоредоксин TRX_STOP переклонировали по сайтам Nde I и Xho I в вектор pTTS, производный вектора pTWIN1 (Рис. 11).
Вектор pTTS был получен из коммерчески доступного вектора pTWIN1. Из вектора pTWIN1 был удалён участок фланкированный сайтами Xba I и Bam HI и по образовавшимся липким концам была лигирована вставка, содержащая сайт рестрикции Xho I (Рис. 12).

Рис. 11. Схема олигонуклеотидной вставки TTS

Рис. 12. Схема получения плазмиды pTTS
Амплифицированный ген TrxSTOP был клонирован в вектор pTTS по сайтам рестрикции Xba I и Xho I (Рис.13).

Рис. 13. Схема получения плазмиды pTTS-TrxSTOP
Из плазмиды pTTS-TrxSTOP был вырезан фрагмент фланкированный сайтами Sap I и Xho I. По образовавшимся липким концам лигировали амплифицированный ген hVEGF165. В итоге, была получен плазмидный вектор pTTS-VEGF165 (Рис.14).
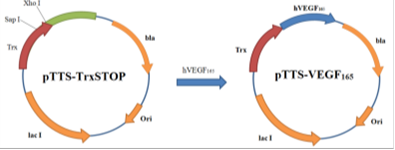
Рис. 14. Схема получения плазмиды pTTS- VEGF165
Лигазной смесью трансформировали компетентные клетки E. coli ER2566 и высеивали на твёрдую питательную среде LB Agar, содержащую 100 мкг/мл ампицилина. Полученные колонии рекомбинантов анализировали на содержание и уровень экспрессии тиоредоксина и hVEGF165 методом ПААГ электрофореза в денатурирующих условиях. На основании данных SDS ПААГ электрофореза были отобраны клоны №2,3 для дальнейшей работы.

Рис. 15. Электрофореграмма (15% SDS-ПААГ) суммарных клеточных лизатов различных клонов E. coli ER2566/ pTTS- VEGF165. Где A-h VEGF165, B-тиоредоксин.
Из клонов №2, 3 выделили плазмидную ДНК (pTTS-hVEGF165). Плазмидной ДНК клона № 2 (pTTS-hVEGF165) трансформировали клетки E. coli ER2655 и осуществили наработку биомассы ER2566/pTTS-hVEGF165. Полученную биомассу лизировали с помощью ультразвукового дезинтегратора. Осветлённый лизат после центрифугирования хроматографировали на анионообменной смоле Q Sepharose (GE Healthcare). Фракции анализировали методом ПААГ электрофореза в денатурирующих условиях на наличие целевого белка. Фракции, содержащие 90% hVEGF165, были объединены. В объединенных фракциях методом Бредфорд определяли концентрацию белка. В результате конечный выход целевого белка составил 7 мг с литра культуры. Не смотря на низкий выход целевого белка, продукция тиоредоксина была значительной, что отчётливо видно на хроматограмме. (Рис.15).
Таблица 1
Содержание полипептидных продуктов на всех стадиях выделения и очистки рекомбинантного белка hVEGF165 из биомассы E. coli ER2566/ pTTS- VEGF165.
|
Этапы очистки |
Общий белок (мг) |
Содержание ГБ (%) |
Содержание hVEGF165 (%) |
|
Осветлённый клеточный лизат |
473 |
10 | |
|
Ионообменая хроматография на сорбенте Q XL |
21 |
90 |